Gobierno de Piñera oficializó documentos sobre posibles efectos secundarios de la vacunación el último día de su mandato
31 marzo, 2022
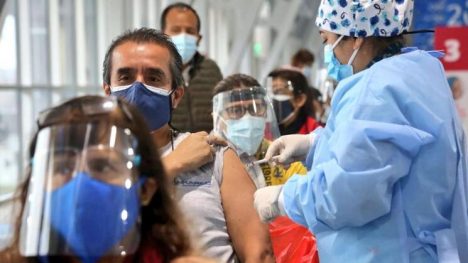
A horas de entregar la administración del Estado el ex Presidente Sebastián Piñera, desde la Subsecretaría de Salud Pública fueron enviadas a publicación en el Diario Oficial 20 Resoluciones Exentas de trámite en Contraloría, las cuales daban aprobación a diversas decisiones que se tomaron durante el año 2021, en torno al programa de vacunación de emergencia generado a partir de la crisis sanitaria. Un grupo de estos daba cuenta de “Eventos Supuestamente Atribuibles a Vacunación e Inmunización” (ESAVI), relacionados con las vacunas Pfizer y Moderna, en el caso de posibles cuadros de miocarditis y pericarditis tras la inoculación, así como de AstraZeneca por casos de trombosis con trombocitopenia. Pese a que las notas de farmacovigilancia –elaboradas a mediados del año pasado, en pleno proceso de refuerzo de la vacunación– advertían que "a través de la presente nota se entregan recomendaciones, tanto para los profesionales de la salud como para la comunidad a fin de que se puedan reconocer de manera oportuna estos eventos", estos documentos recién fueron acogidos a tramitación el 10 de marzo del presente año y publicados en el Diario Oficial el día 23 de este mes. Diversas fuentes del mundo de la salud sostienen que es preocupante que "estos temas no hayan sido abiertos y conocidos por la población, porque, finalmente, estos mantos de dudas que se empiezan a generar con esta publicación el último día de Gobierno, cuando no tenemos reportes en línea de estos efectos secundarios, cuando los expertos no pueden aparecer explicando justamente esto, efectivamente genera una mayor amenaza a algún tipo de beneficio que pueda generarse sobre los programas de vacunación". Exautoridades del Ministerio de Salud, como Jaime Mañalich, restan importancia al hecho, atribuyéndolo a meros trámites burocráticos.
El 10 de marzo, bajo la administración anterior y un día antes del cambio de Gobierno, desde la Subsecretaría de Salud Pública fueron firmadas 20 resoluciones exentas sobre distintas decisiones vinculadas a la inoculación de la población para enfrentar la pandemia de COVID-19. Fue el 23 de marzo cuando estos documentos se oficializaron al aparecer publicados en el Diario Oficial, lo que en términos legales en nuestro país se asume como materia sabida por toda la población. El punto es que los documentos habían sido evacuados siete meses antes por el Instituto de Salud Pública (ISP) al Ministerio de Salud (Minsal), sin que la población haya sido informada oportunamente.
Pero como resulta obvio, lo que se presume sabido, no lo es. Dentro de los documentos –a los cuales se les dio tramitación legal solo el último día hábil del Gobierno del ex Presidente Piñera– se cuentan varios ESAVI serios (Eventos Supuestamente Atribuibles a Vacunación e Inmunización), que no es otra cosa que alertas públicas, basadas en la experiencia y estudios internacionales, y directrices de organismos mundiales de vigilancia sanitaria en relación con la inmunización. En dos de estos documentos, se habla de posibles casos de afecciones cardíacas como miocarditis y pericarditis, sobre todo en población adolescente, y otros casos relacionados con trombosis, a consecuencia de la inoculación de determinadas vacunas.
Con casi 10,5 millones de casos en la última semana en el mundo, el COVID-19 sigue siendo una preocupación a nivel global, aunque las campañas de inmunización avanzan a ritmo sostenido en la mayoría de los países. En este contexto es que diversos centros en el mundo, como el caso del Centro para el Control y Prevención de Enfermedades de los EE.UU. (CDC por sus siglas en inglés), decidieron activar un "monitoreo activo" sobre casos de miocarditis y pericarditis que se reportaron en personas vacunadas con los sueros de Pfizer-BioNTech y Moderna, razón por la cual iniciaron campañas de información para que la población tomara conocimiento oportuno y oficial de los efectos adversos que podrían presentar algunas personas tras la vacunación.
Debido a lo delicado de la materia, las autoridades de salud locales también tomaron conocimiento de estas anomalías a través de sendos informes que evacuó el Instituto de Salud Pública (ISP) a la Subsecretaría de Salud, en forma de ESAVI, en diversas fechas del primer y segundo semestre del año pasado. Fue así como el 21 de agosto de 2021, el ISP evacuó el documento "ESAVI Serio: Miocarditis y/o Pericarditis". Y después lo reiteró en otro informe el 23 de septiembre del mismo año.
En el numeral 9° de este documento se plantea que “desde abril 2021, se han reportado a nivel mundial casos de miocarditis, pericarditis y miopericarditis, posteriores a la inmunización con vacunas que utilizan la plataforma ARNm, como lo son la vacuna del laboratorio Pfizer-BioNTech (Comirnaty) y del laboratorio Moderna (Spikevax)". A consecuencia de ello, en el punto siguiente se describe que "en virtud de lo anterior es necesario describir las principales características de la presentación clínica y recomendaciones para el diagnóstico y tratamiento de este cuadro, de acuerdo con la evidencia científica disponible hasta la fecha".
La nota informativa de farmacovigilancia del 23 de septiembre hace hincapié en un punto esencial: "A través de la presente nota se entregan recomendaciones, tanto para los profesionales de la salud como para la comunidad a fin de que se puedan reconocer de manera oportuna estos eventos".
Pese a que este documento requería –dada lo importancia de la materia– una tramitación inmediata, para que así la comunidad en general tomara conocimiento de las posibles afecciones cardiacas, detectables con atención a los síntomas como dolor de pecho, dificultad para respirar y sentimientos de tener el corazón acelerado o palpitante, la autoridad sanitaria del Gobierno saliente recién le dio curso legal a este ESAVI el 10 de marzo de este año, aprobando el documento a través de la “Resolución Exenta Número 442", publicada en el Diario Oficial el 23 de marzo, más de siete meses después que la autoridad tomara conocimiento de la alerta.
Igual destino tuvo el "ESAVI serio: Síndrome de Trombosis con Trombocitopenia” de mediados de marzo de 2021 y que emanó como actualización, al 13 de septiembre de 2021, de la Subsecretaría de Salud Pública, División de Prevención y Control de Enfermedades, Departamento de Inmunizaciones. En este documento se señala que "desde mediados de marzo 2021, se han reportado a nivel mundial casos de trombosis asociados con trombocitopenia, posteriores a la inmunización con vacunas de vectores de adenovirus, como lo son la vacuna del laboratorio AstraZeneca (Vaxzevria) y del laboratorio Johnson & Johnson (Janssen)”. Y resuelve aprobar el documento denominado "ESAVI serio: Síndrome de Trombosis con Trombocitopenia (STT)". Tal como el anterior, a este ESAVI se le dio curso el 10 de marzo de este año, a través de la “Resolución Exenta Número 437, de 2022".
Ambos documentos tenían como precedente un informe previo, el "Informe de ESAVI Notificados Primer Semestre 2021", que en su punto 9º indica que “desde el 24 de diciembre de 2020 hasta el 30 de junio de 2021, el PNI ha recibido un total de 7.208 notificaciones de ESAVI, vale decir de personas que presentaron algunos de los síntomas descritos en los documentos posteriores. Por esa razón, es que la resolución exenta a través del cual se le da cumplimiento, se advierte de manera categórica que "en virtud de lo anterior es necesario aprobar el documento denominado 'Informe de ESAVI Notificados Primer Semestre 2021'", pero pese a ser entregado el 2 de agosto de 2021, recién se aprobó el 10 de marzo de 2022.
Del mismo modo en otro documento, también de marzo de 2021, dado a conocer por medio de la Resolución Exenta Número 392, de marzo del año siguiente, se entregan datos estadísticos sobre vacunación en personas mayores de 18 años, mostrando, por ejemplo, que “hasta el día 31 de diciembre (2021), se habían administrado 13.900.002 dosis de la vacuna SARS-CoV-2 Pfizer-BioNTech a personas desde los 18 años. El total de notificaciones recibidas en el SDFV asociadas a esta vacuna fueron 5.894, lo que corresponde a una tasa de notificación de 42,40 reportes cada 100.000 dosis administradas de la vacuna SARS-CoV-2 Pfizer-BioNTech".

Los eventos no serios que presentaron mayor tasa de notificación son los relacionados con la zona de inyección, seguido por cefalea, fiebre, dolor muscular, fatiga y dolor articular. En cuanto a las manifestaciones más frecuentes de los ESAVI Serios, reportadas para la vacuna SARS-CoV-2 Pfizer-BioNTech, se indica:

Falta de transparencia
Si bien esta información fue de conocimiento de los servicios médicos en general, a través de publicaciones en la página web del ISP, no se dieron a conocer abiertamente a la población, tal y como lo advierte el doctor José Miguel Bernucci, secretario nacional del Colegio Médico.
“Lo más sano y recomendable es que todos estos temas sean abiertos y conocidos por la población, porque, finalmente, estos mantos de dudas que se empiezan a generar con esta publicación el último día de Gobierno, cuando no tenemos reportes en línea de estos efectos secundarios, cuando los expertos no pueden aparecer explicando justamente esto, efectivamente genera una mayor amenaza a algún tipo de beneficio que pueda generarse sobre los programas de vacunación. Y la mayor amenaza o problema de esto se da porque mucha de esta información, al no tener contexto claro, es usada por los grupos antivacunas”, señala.
Dentro de los episodios más graves está el caso denunciado de fallecimiento de una joven deportista de 28 años presuntamente por inoculación, ya que familiares y amigos indican que su deceso se produjo 35 horas después de haber sido vacunada. Tras esta denuncia y posterior querella está la doctora Diana Pey, quien plantea que “es una falta a la veracidad y de responsabilidad para con la ciudadanía, no informar activamente estos datos de los ESAVI. Es necesario que haya conocimiento claro de los posibles efectos adversos, como lo hacen en Japón, que publicaron las listas de esos problemas en los muros y entradas de hospitales”.
Vea aquí resoluciones exentas:
La respuesta del ISP
“Este es un acto administrativo, que aprueba el documento, pero en el fondo los documentos que sacó el Programa Nacional de Inmunizaciones quedan aprobados por Resolución. La fecha o por qué lo hicieron el día 10 lo desconozco, pero ese es el proceso. Y nosotros, independiente de eso, estuvimos sacando los diferentes informes de ESAVI, llevamos ocho de adultos y tres de niños”, aclara Heriberto García, director subrogante del ISP y, según fuentes de salud, hombre muy cercano al ex Mandatario.
Según García, el contenido de los ESAVI "está socializado". "La oficialidad que da la resolución es simplemente dar peso al documento, pero en lo técnico y regulatorio no tiene ningún peso, es simplemente una resolución administrativa. Pero desde el punto de vista técnico, y comunicacionalmente, esto se ha informado”, asegura.
Misma visión tiene el también exministro de Salud, Jaime Mañalich. “Hay algunos aspectos que no han sido formalmente oficializados, ello ocurre en muchas carteras en los últimos días de Gobierno para hacer los traspasos. En el caso particular de los efectos adversos ESAVI, lo que hace es darle un carácter oficial a ese trabajo, que era público, como es la comunicación de potenciales efectos adversos de las vacunas COVID. En ese sentido no es un tema muy relevante, no acarrea responsabilidad administrativa, y es una costumbre bastante habitual, creo yo, que se trate de ordenar estas cosas en los últimos días para hacer la entrega o traspaso de Gobierno bien”, dice.
Casos similares, restricciones diferentes
Cabe indicar que solo respecto de la vacuna AstraZeneca, en agosto del año pasado –y posterior a la evacuación de los ESAVI–, se definió la restricción de esta solo para su uso en mujeres mayores de 55 años y en varones mayores de 45. Fuentes de la industria señalan que, más allá de que se indicó que había 179 casos vinculados a trombosis posvacunación, se estableció que solo en tres casos había evidencia de que la inoculación provocó esos efectos adversos.
Exautoridades del área salud explican que, en este tema, a nivel mundial se generó un volumen de casos importante de efectos adversos, principalmente en mujeres que recibieron AstraZeneca, y por eso en Chile, “sin que hubiera una prueba científica que así lo avalara, se tomó una decisión más allá de eso (recomendación mundial) y se prohibió y corrigió su uso”, según describe el exministro Mañalich.
Pero esto, además, da cuenta de un tratamiento diferencial de la información, ya que en una situación similar no ocurrió así con Pfizer, pese a contar con sendos informes que daban cuenta de las alertas. Cabe recordar que, tras ese episodio, el Gobierno de Sebastián Piñera no renovó compras con AstraZeneca, pero sí con Pfizer-BioNTech, con el cual, pese a presentar casos de miocarditis u otros registrados, sí se renovaron compromisos para adquirir más de estas vacunas.









